Science
私たちのアプローチ
私たちは網膜外層疾患に焦点を当てた先進的な治療法の開発と実用化に専念しています。患者さんの病態に合わせた個別化された治療戦略の研究は、当社の主要なミッションの一つです。この目的のため、iPS細胞を用いて視細胞と網膜色素上皮(RPE)細胞を特別に誘導・増殖させる技術を開発しています。さらに、移植の効果を最大化するための手術手技やポストオペラティブケアについても綿密な研究を行っています。疾患の早期診断から治療選択、長期的なフォローアップに至るまで、包括的かつ多角的なアプローチで患者さんの生活の質を向上させることを目指しています。これらの研究成果は国際的な学術誌にも掲載されており、神戸市立神戸アイセンター病院と密接な連携を持ちながら臨床応用に取り組んでいます。
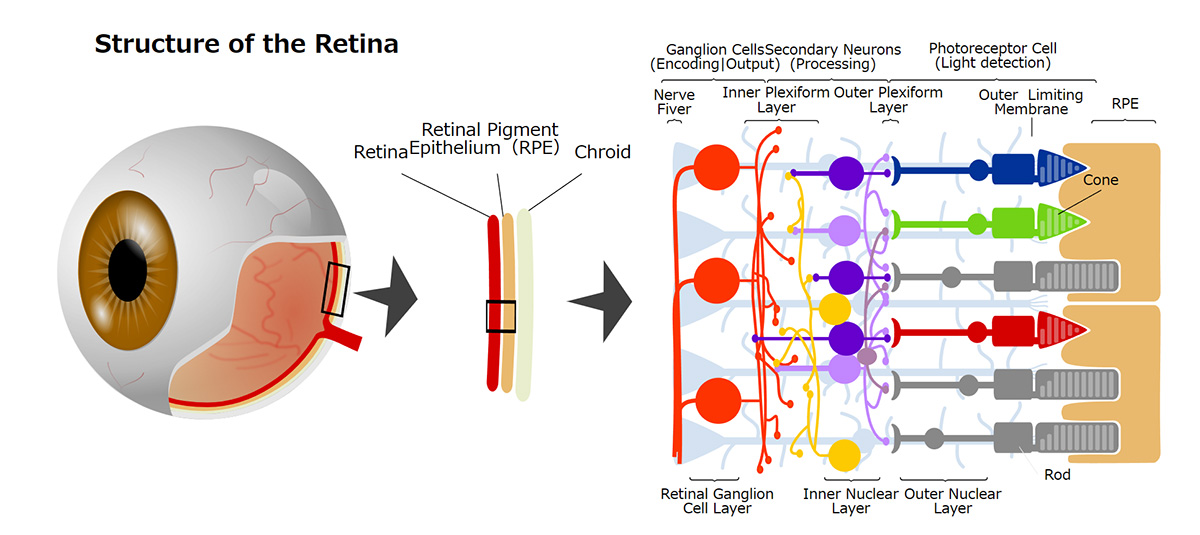
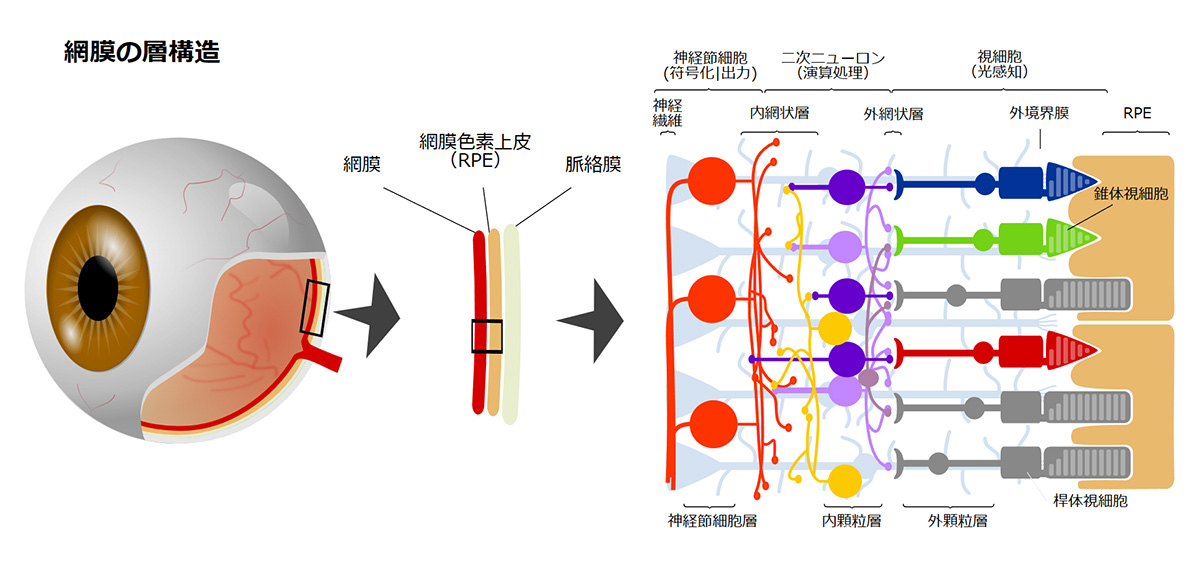
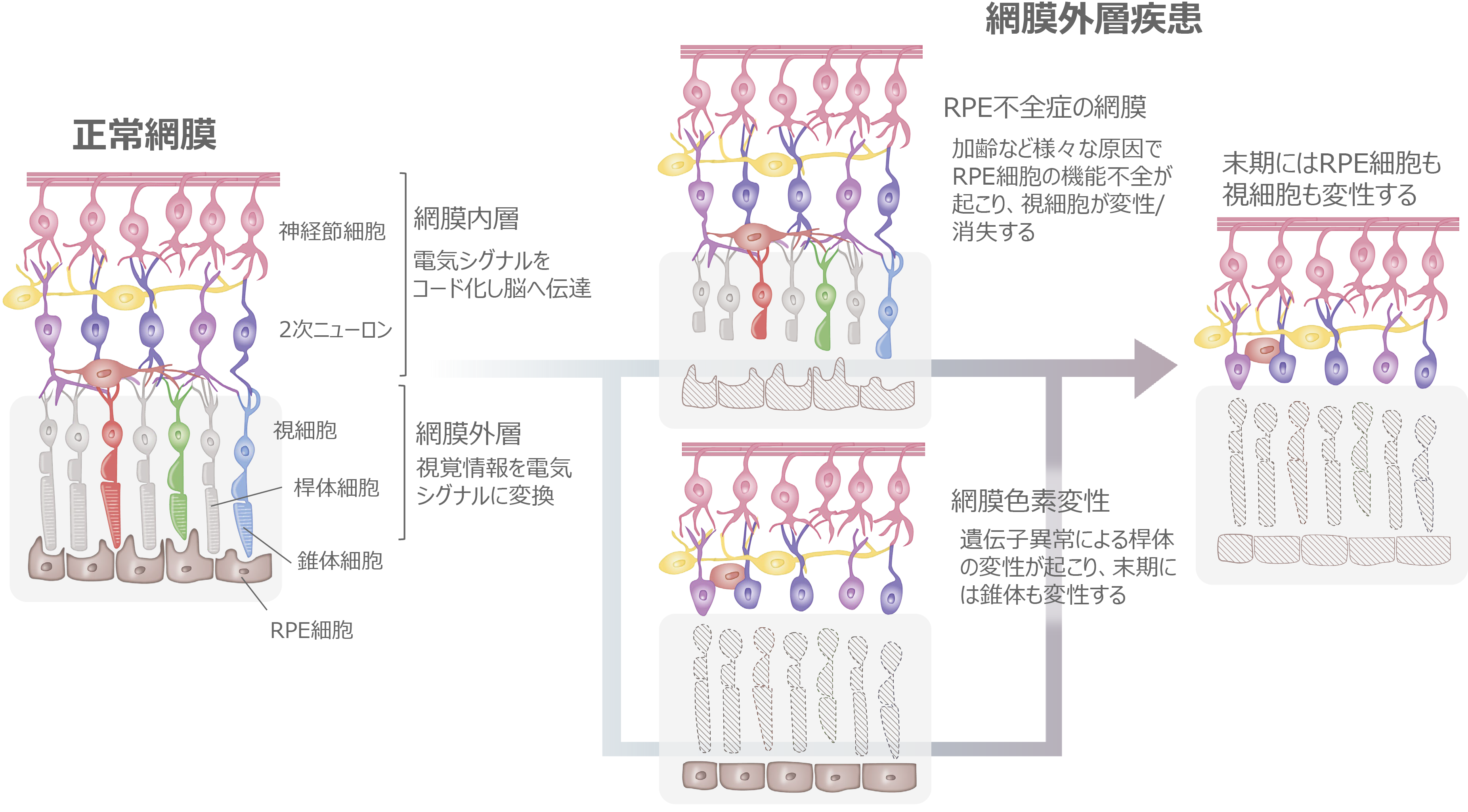
網膜外層疾患
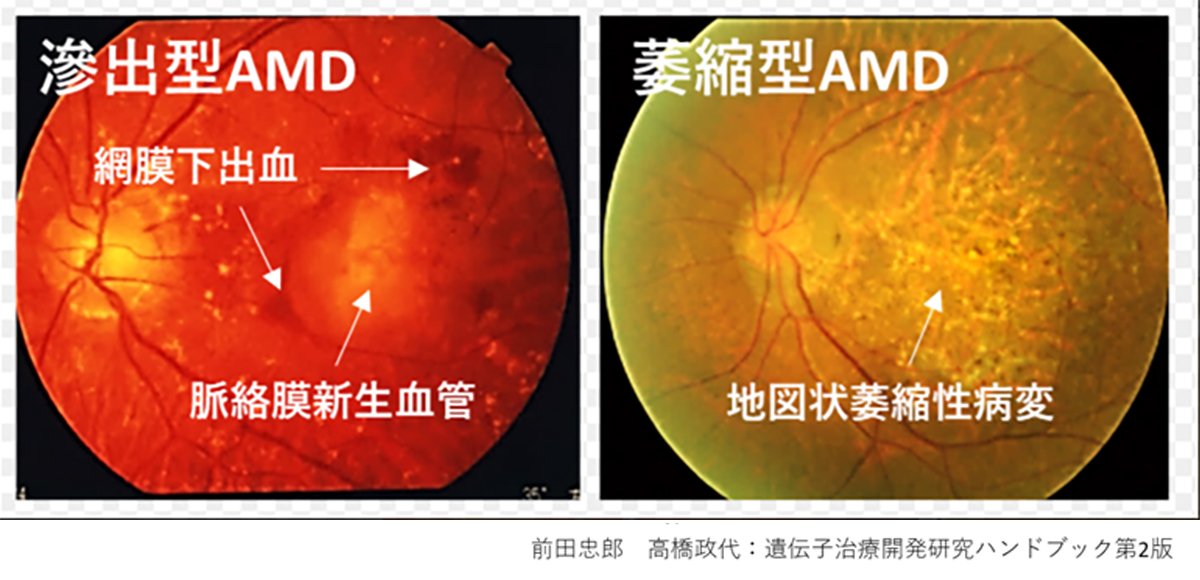
現在、日本をはじめとする高齢化の進む国において、網膜色素変性や加齢黄斑変性(AMD)等が中途失明原因の上位となり、その治療法の開発が求められています。これらの疾患はいずれも網膜外層の変性が原因となり視覚障害が引き起こされますので、私たちは網膜外層疾患と呼んでいます。網膜外層疾患には様々な網膜疾患が含まれており病態も様々ですが、共通しているのは網膜外層に存在する視細胞や網膜色素上皮(RPE)細胞に障害が起きるという点です。この視細胞変性やRPE細胞不全では変性を起こした細胞は再生しないため不可逆的に病状が進行するうえ、現在も有効な治療方法はありません。そこで、私たちは再生医療としてiPS細胞由来視細胞及びRPE細胞移植治療を開発し、ひとりひとりの患者さんの病態にあった治療を提供することを目指しています。
RPに対する治療の現状とその限界
日本国内で網羅的な遺伝子診断スクリーニングにより診断がつくのは4割から5割とされています。RPは国の指定難病の一つであり、その罹患者数は4000人から8000人に1人とされ、日本国内では約3万人、世界的には約300万人と言われています。
この病気では、多くの場合、最初に現れる症状は、暗いところでものが見えにくくなる夜盲です。その後、見える範囲(視野)が周辺部分から中心に向かい狭くなっていく視野狭窄が少しずつ進行していきます。さらに症状が進むと、視力の低下や、色の区別がつきにくくなる色覚異常が起きてくることが多いです。病気が進む速さは患者さんによって異なります。また、症状の組み合わせや順番にも個人差があり、最初に視力の低下や色覚異常で発見され、後から夜盲を自覚する患者さんもいます。
RPには現在確立した治療法はなく、対症的に遮光眼鏡の使用や、ビタミンAや循環改善薬の服用などが行われることがあります。遺伝子治療や人工網膜が実用化されつつありますが、今のところ、広く行うことができる治療法とはなっていません。私たちは、iPS細胞から作製した視細胞を含む網膜シートを、視細胞が変性した患者さんの網膜に移植することにより、視機能を回復させることを目指す再生医療を開発しています。また、原因遺伝子が網膜色素上皮(RPE)の遺伝子の場合はRPEを移植することで視機能を維持することができる治療も計画しています。
RPE不全症とは
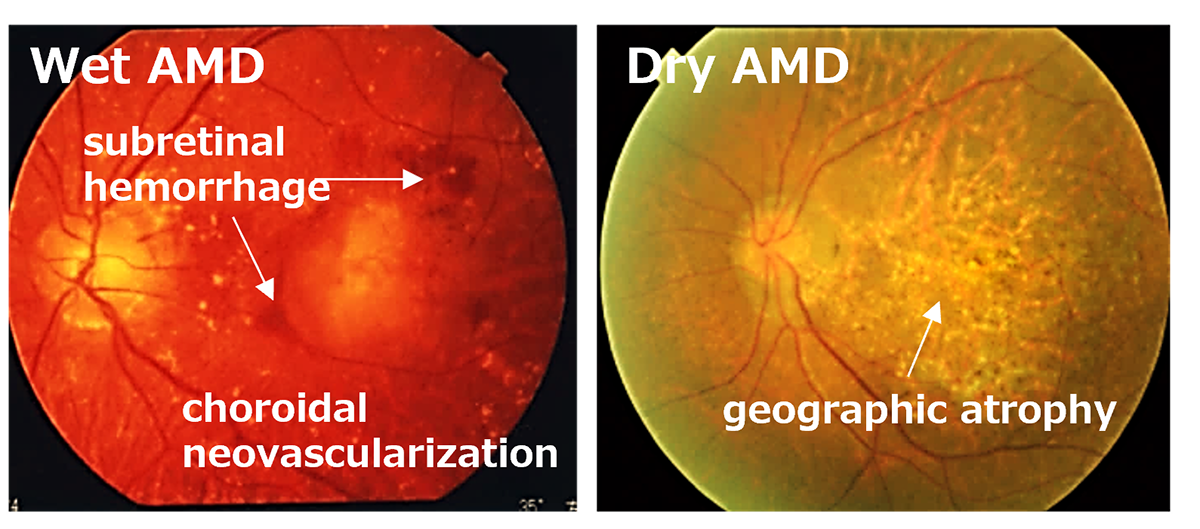
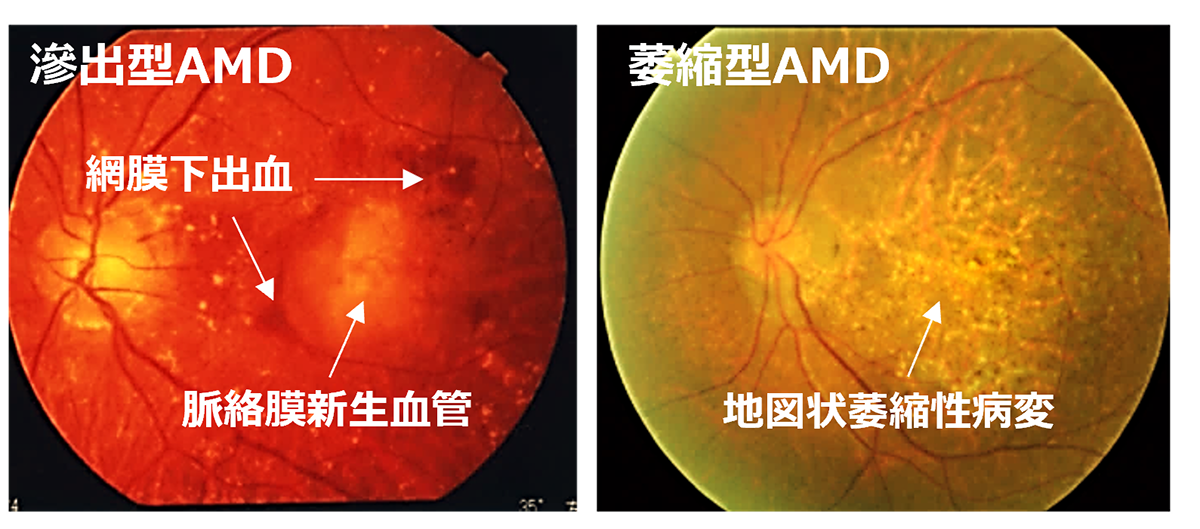
RPEは私たちの視覚を維持するために様々な重要な役割を担っていることから、RPEに発現する遺伝子異常や加齢に伴う酸化ストレス及び老廃物の異常蓄積等加齢に伴う病的変化が原因となり、RPE不全を来すことで遺伝性疾患群である網膜色素変性や、これまでのRPE細胞移植臨床研究の対象疾患であったAMDの主な原因となることが知られています。事実、RPE不全が主な原因である網膜変性疾患が複数存在することから、これらの網膜変性疾患をRPE不全症という一つの疾患群としています(1)。これらの疾患には、網膜色素変性の類縁疾患であるクリスタリン網膜症や網膜色素変性のうちRPE関連遺伝子異常を伴うもの等(RPE65、RDH5、MERTK等の遺伝子に異常を伴うもの)希少な遺伝性網膜変性疾患や、指定難病に登録されているものから高齢者における一般的な失明原因であるAMDも含まれます。AMDの患者数は日本国内で約70万人、世界では約3億人と言われています。一方で、他のRPE不全症に含まれる疾患の患者数はわかっていません。また、RPE不全症の症状は、視力が低下したり、暗いところでものが見えにくかったり、または色がわかりにくくなることで発見されますが、病気が発見される年齢や、症状の種類と進む速さは、その病気の種、類や患者さんによって個人差があります。RPE不全症の代表例としては加齢黄斑変性が挙げられます。
RPE不全症に対する治療の現状とその限界
RPE不全症に該当すると考えられる網膜変性疾患に含まれるクリスタリン網膜症、ベスト病、スターガルト病、網膜色素変性(RPE関連遺伝子異常を伴うもの:MERTKまたはRPE65遺伝子異常を原因としたもの等)、高度近視、多発性網膜色素上皮症、色素線条でみられるRPE不全に対して、現在も治療法は確立されていません。
一方で、網膜色素変性のうち、RPE65遺伝子異常を原因としたタンパク欠失型の病態によるものに対しては、遺伝子治療が2017年にFDA承認を、2023年には日本国内でも承認受けており、その治療効果が期待されています。しかしながら、遺伝子治療は視細胞変性の早期の段階でなければ効果が得られないことから、病気が進行した場合、適応にならない可能性があります。
現在、AMD患者は、抗酸化物質のサプリメントや抗血管内皮増殖因子(抗VEGF)剤などの日常的な医学的管理を受けることが推奨されています。 ビタミン、ルテイン、ゼアキサンチンを含む前者は、網膜細胞を酸化ストレスから保護するために適用されます。 一方、VEGFに結合してVEGFの受容体への結合をブロックする抗VEGF剤の硝子体内注射は、湿潤型AMDの治療に一般的に使用されています。 しかし、現在の治療法は、この疾患に固有の根本的な変性を標的にしていないため、治療を中止すると高い再発率につながります。 一方、つい最近、乾燥型AMDの治療に抗補体薬が承認されました。 この試薬により GA の進行を改善することが期待されますが、網膜細胞の損失は回復できません。
この様に、RPE不全に対しては、極一部の疾患に見られるRPE機能不全に対する限定的な遺伝子治療が行われているのみで、不全症に含まれる遺伝性疾患と非遺伝性疾患の両方に共通して見られるRPEの変性や脱落に対しては現在も治療方法がなく、我々をはじめとする幾つかのグループによる細胞移植による再生医療が新しい治療方法として試みられています(1,2)。
Reference
- 1. Maeda T, Mandai M, Sugita S, Kime C, Takahashi M. Strategies of pluripotent stem cell-based therapy for retinal degeneration: update and challenges. Trends Mol Med. 2022 May;28(5):388-404. doi: 10.1016/j.molmed.2022.03.001. Epub 2022 Apr 1. PMID: 35370091.
- 2. Maeda T, Sugita S, Kurimoto Y, Takahashi M. Trends of Stem Cell Therapies in Age-Related Macular Degeneration. J Clin Med. 2021 Apr 20;10(8):1785. doi: 10.3390/jcm10081785. PMID: 33923985; PMCID: PMC8074076.
再生医療のアプローチ
幹細胞等を利用して組織、臓器等を再生させることにより、失われた身体機能を取り戻すことを目指す再生医療は、今まで治療法のなかった難治性疾患・重篤疾患やQOL改善が必要な疾患を克服する新しい治療方法として世界から注目を集めています。
この10年間での再生医療の進歩は目覚ましく、特に日本では人工多能性幹細胞(iPS細胞)を用いて、加齢黄斑変性に対する網膜色素上皮細胞移植を皮切りに10以上の臨床試験が開始されています。一方で人体の各組織にある組織幹細胞から作製した、皮膚、軟骨、心筋や間葉系幹細胞等を用いた再生医療等製品が、火傷、軟骨損傷、心不全や脊髄損傷等を対象として保険診療として22品目が日本国内で承認されています。
現在、iPS細胞由来網膜細胞の臨床応用の実用化を目指した取り組みが様々な関連分野で展開されています。他の分野での再生医療には無い網膜再生医療の優位性、すなわち使用する細胞量が少ないことによる製造コスト面での合理性、確立した手術機器と技法、そして患者さんの網膜を直接見ることが可能な精度の高い画像診断技術を最大限に有効活用した網膜再生医療戦略の発展を当社が担っていきます。
多能性幹細胞による再生医療のアプローチ
人工多能性幹細胞(iPS細胞)とは
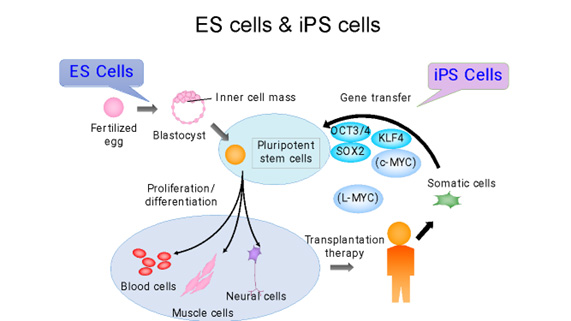
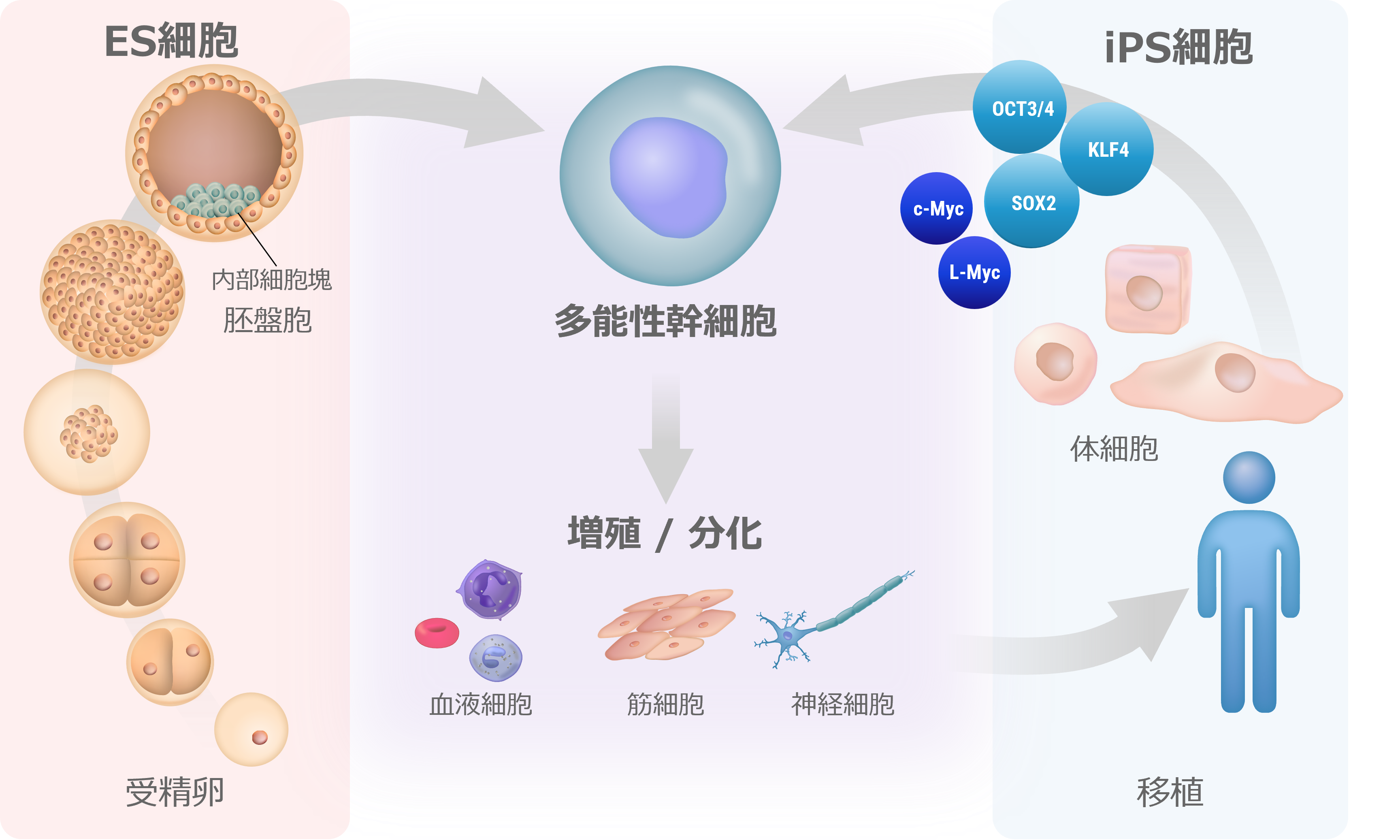
人工多能性幹細胞(iPS細胞)とは、成人の細胞のエピゲノムを初期化(リプログラミング)して胚性幹細胞(ES細胞)のような状態にした幹細胞の一種です。このプロセスにより、細胞は体内のほぼすべての種類の細胞に分化する能力を持つようになります。
iPS細胞は、京都大学の山中伸弥教授らが、2006年にマウスの皮膚細胞から世界で初めて樹立に成功したと報告しました。山中教授の研究チームは、まず、細胞の多能性(あらゆる種類の細胞になる能力)を維持する鍵になると思われる24の遺伝子を選び出し、皮膚細胞に挿入しました。一つずつ遺伝子を減らす消去法で、これらの成体細胞を胚の状態に再プログラムするのに必要な遺伝子は4つだけであることを発見しました(1)。(それらはOct3/4、Sox2、c-Myc、Klf4であり、現在では山中因子として知られています。)この発見は、体内のあらゆる細胞を胚から得られる多能性幹細胞ES細胞様の細胞に変える可能性があることを意味し、タイムマシンの様な研究と呼ばれる革命的な発見でした。iPS細胞は患者自身の細胞から作ることができるため、移植による拒絶反応のリスクを軽減した個別化治療、創薬、病気のモデル化などに利用できる可能性があり、爆発的に研究が広がりました。その功績が認められ、細胞の初期化(リプログラミング)の概念に関する先駆的な研究を行ったジョン・ガードン博士と共に山中教授は「2012年・ノーベル生理学・医学賞」を受賞し、その後も数々の賞を受賞しました。
再生医療に用いる細胞(体幹細胞・ES細胞・iPS細胞)
ES細胞、iPS細胞、体性幹細胞などの幹細胞は、自己複製能と多能性を特徴としています。ES細胞は、受精後に胚盤胞内の細胞塊から分離して確立された幹細胞であり、ほとんどすべての細胞(組織)に分化することができます。ES細胞様多能性幹細胞としてされたiPS細胞は、京都大学の山中伸弥教授により、4つの転写因子(Oct3 / 4、Flk1、Sox2、c-Myc)を用いてマウス線維芽細胞から誘導されました。翌年、同グループがヒトiPS細胞の作製に成功し、現在、再生医療や創薬支援などの医療分野だけでなく、若返り、および老化プロセス、細胞分化のメカニズム解明などの基礎研究にも幅広く活用されています。
一方で、成体体性幹細胞は生体組織に存在し、特別なニッチの微小環境で維持され、発達過程および組織損傷のために失われた細胞を補充することによって組織再生に関与していると考えられています。
iPS細胞の昨今のトレンド: 遺伝子編集
最初は皮膚細胞から作られたiPS細胞ですが、その後は様々な細胞から作れることが報告され、現在では血球細胞から作られることが多くなり採血するだけで作れるようになっています。導入遺伝子の改変も行われ、導入方法もレトルウイルスから始まり、プラスミド、センダイウイルスと報告され、現在ではmRNAでもiPS細胞が作れます。しかし、iPS細胞はヘテロな集団であり、同じ製法であっても個体差も大きく遺伝子発現レベルでは性質が大きく異なります。たとえ同じ細胞株でも細胞技術が異なれば同じプロトコールでも維持培養や継代の際に異なった状態に変化してしまいます。
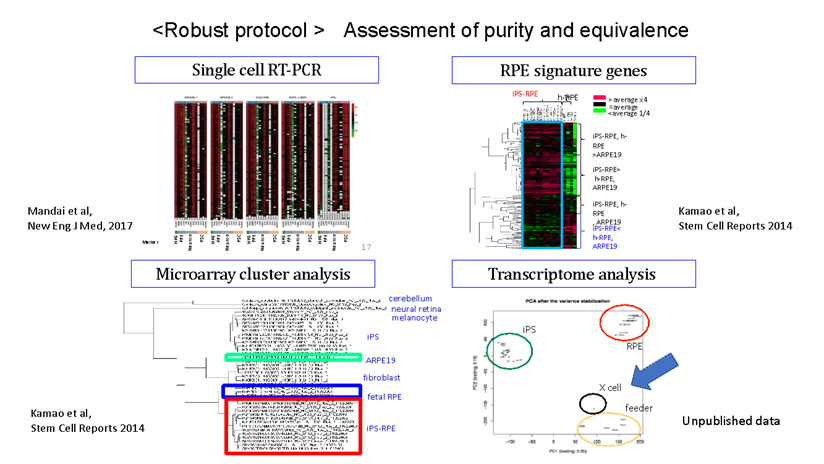
私たちが世界初のiPS細胞の応用例を行った際に、これらの幹細胞研究の経験から、網膜色素上皮(RPE)細胞という転移性腫瘍の報告が歴史上全くない細胞に純化することによって、患者ごとに違うiPS細胞であっても常に同じ機能を持つ安全な細胞を作れるように頑健な(robustな)製法を採用しました(2)(図2)。この方法によって自家移植を可能とし、免疫拒絶を回避することができたのです。
免疫応答の回避
細胞膜表面分子であるヒト白血球抗原(Human Leukocyte Antigen; HLA)は多型性に富み、生体の免疫システムにおいて、自己と他者の区別に使われます。免疫システムは、自己の遺伝子でコードされてないHLAを膜表面に提示する細胞を非自己と認識して排除することで体を守る一方、移植医療においては、他者由来の移植片を異物とみなして排除してしまいます。これが、臓器(細胞)移植における拒絶反応です。
拒絶反応を回避するため、京都大学iPS細胞研究所(CiRA)では、再生医療用iPS細胞ストックプロジェクト(※)を立ち上げ、HLA主要6座(HLA-A, -B, -C, -DP, -DQ, -DR)がホモ接合対であるドナーから作製したiPS細胞を広く提供しました。これにより、HLA主要6座のすべてにおいて、遺伝子対の少なくとも片方が移植細胞と一致する患者は拒絶反応が起きにくくなります。
(※) iPS細胞ストックを提供する事業は、2020年4月から公益財団法人京都大学iPS細胞研究財団(CiRA_F)へ引き継がれています。
Reference
- 1. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Takahashi K, Yamanaka S. Cell. 2006 Aug 25;126(4):663-76.
- 2. Characterization of human induced pluripotent stem cell-derived retinal pigment epithelium cell sheets aiming for clinical application. Kamao H, Mandai M, Okamoto S, Sakai N, Suga A, Sugita S, Kiryu J, Takahashi M. Stem Cell Reports. 2014 Jan 23;2(2):205-18.
- 3. HLA-Matched Allogeneic iPS Cells-Derived RPE Transplantation for Macular Degeneration. Sugita S, Mandai M, Hirami Y, Takagi S, Maeda T, Fujihara M, Matsuzaki M, Yamamoto M, Iseki K, Hayashi N, Hono A, Fujino S, Koide N, Sakai N, Shibata Y, Terada M, Nishida M, Dohi H, Nomura M, Amano N, Sakaguchi H, Hara C, Maruyama K, Daimon T, Igeta M, Oda T, Shirono U, Tozaki M, Totani K, Sugiyama S, Nishida K, Kurimoto Y, Takahashi M. .J Clin Med. 2020 Jul 13;9(7):2217.
網膜色素上皮(RPE)細胞の再生
当社の前身である理化学研究所網膜再生医療研究開発プロジェクト(以下、網膜再生PJ)の研究チームにおいて、世界に先駆けて加齢黄斑変性の患者さんを対象に、iPS細胞を用いた網膜色素上皮(RPE)細胞ならびに同種(他家)のRPE細胞を、その患者さんの病状に適した移植方法で網膜の下に移植する臨床研究を実施しました。これまでに、自家と同種(他家)細胞移植ともに細胞自体の安全性が確認されています。また同種(他家)移植においては、移植細胞と患者さんのHLAを合わせることで、免疫抑制剤を投与しなくても拒絶反応を安全に管理できることもわかりました。現在、移植した患者さんの視力は変わらずに維持されています。これらの研究開発はVC Cell Therapyに引き継がれ、変性により機能を失ってしまった網膜機能の再生を目指して、神戸市立神戸アイセンター病院との共同研究を進めています。

網膜色素上皮(RPE)細胞の臨床応用
2014年、当社の前身の理研 網膜再生PJは、世界に先駆けて滲出型加齢黄斑変性の患者を対象に、患者自身のiPS細胞から作製したRPE細胞の、網膜下への移植を実施しました(1,2)。これは、2006年にiPS細胞が発明(3)されてから、世界で初めて実現したヒトiPS細胞の臨床応用で前例のない移植治療であったため、全ゲノムおよびエクソーム解析を含む厳しい品質管理検査がおこなわれ、多くの規制を乗り越えて、大きな第一歩が踏み出されました。
本臨床研究では、科学的に最も良い治療でありiPS細胞の特性を生かした自家iPS細胞由来RPE移植の安全性を確認することを目的としていました。新生血管抜去とiPS細胞由来RPEシートの移植が実施されましたが、手術手技に伴う有害事象はみられませんでした。その後1年間の経過観察において、移植片の異常増殖や拒絶を示す所見は認められず、 移植片上の網膜構造も良好に維持されていました(1)。また術後7年の時点でも、iPS細胞由来RPEシートは、移植された場所にとどまり、腫瘍化など異常な細胞増殖もみられていません。患者は手術当時78歳で、滲出型加齢黄斑変性にともなう網膜下の血管新生を抑制するために、手術前に抗VEGF製剤の眼内注射を計13回受けていましたが、手術後は7年以上にわたって治療薬の眼内注射を受けることなく、手術前の視力を維持しています(4)。
自己のiPS細胞から作製された移植片を用いる治療は、究極のテイラーメイド医療と言えます。移植細胞のHLAが患者自身の遺伝子でコードされているので、HLA不適合による拒絶応答を抑制するための免疫抑制剤を使用する必要がありません。
特に高齢者に対する免疫抑制剤の使用は、患者に体力的な負担を強いることになり、その点において自己のiPS細胞を使用する大きな意義があります。その一方で、患者ごとにiPS細胞を樹立し、目的細胞を作製するプロセスは、大変な準備期間と労力、そして莫大なコストを要します。それらのバランスを考慮しながら、自己のiPS細胞をもちいた治療を必要とする患者に提供する仕組みが今後必要になります。
移植網膜色素上皮細胞(RPE)の剤形
RPE細胞は網膜下でシート状の組織となり機能しますが、移植の際にはなるべく眼球及び網膜の切開が小さい方が手術は安全です。最初からシートである方が移植片を移植部位に狙い通り投入することができる一方で、RPE細胞シートの作製に手間と時間を要し、また移植時の網膜の侵襲が大きくなる短所があります。それに対して、細胞懸濁液で投与して網膜下でシートを作らせる方法は、作製や保存が比較的容易であり、手術切開も小さな穴だけで良い一方、移植部位へ必要な細胞数を確実に投与することが困難となります。
そこで、細胞シートと細胞懸濁液の短所を補い、両者の長所を活かすべく開発されたのが、RPE凝集紐です(4)。iPS細胞から分化誘導したRPE細胞を、細い溝で2日間培養すると、直径約200μm、長さ約2cmの凝集塊ができます。その紐状の凝集塊を培養ディッシュにのせると、翌日以降、凝集紐からRPE細胞が生え出す様子が観察され、継続培養することでBEST1やZO-1といった成熟RPEマーカーを発現しながら細胞がシート状に広がる様子が認められました。また、凝集紐の状態で保存することも可能です。
2022年11月、RPE凝集紐の形で臨床研究が開始され、凝集紐が最小限の侵襲で、網膜下の狙った部位へ投与することができ、細胞シートと細胞懸濁液それぞれの短所を補完することが示されました。また、移植後数週間で単層のシート状に広がり、生着するのが認められました。現在はこの紐製剤を、Ready-to-useの形で国内外に提供するために、輸送方法を含め検討をおこなっています。
免疫回避の遺伝子編集をした色素上皮細胞
iPS細胞を用いた移植において重要な要因の一つは、細胞を受け取る側の免疫反応です。私たちの2014年の初めての臨床試験では、拒絶反応のリスクを最小限に抑えるために、患者自身の体から作製した自家のiPS細胞を使用しました。免疫システムは、非自己のHLAを持つ細胞を排除し、体を保護します。したがって、自家移植においては、HLAの不一致による拒絶反応を管理するための免疫抑制剤は必要ありません。ただし、このアプローチには欠点もあり、各患者用にiPS細胞を確立する必要があるため、準備時間、労力、および費用がかかります。
iPS細胞を用いた移植の拒絶反応を回避するため、京都大学iPS細胞研究所(CiRA)では、再生医療用iPS細胞ストックプロジェクト(1)を立ち上げ、HLA主要6座(HLA-A, -B, -C, -DP, -DQ, -DR)がホモ接合体であるドナーから作製したiPS細胞を広く提供しました。私たちはこのHLA6座ホモのiPS細胞を用いて、HLA6座適合の他家iPS-RPE移植を全身的免疫抑制剤の投与なしに高齢の加齢黄斑変性患者の網膜下に移植し、すなわちHLA非適合の影響がなければ局所のステロイドのみで拒絶反応を完全にコントロールして生着させることに成功しています (3)。
HLA適合細胞の利点にもかかわらず、この方法は依然として、CiRAが提供する6つの主要なHLA同型のiPS細胞とHLA型が一致する患者に限られています。そこで我々は、独自にHLA主要6座の一部の発現を遺伝子編集により除去したiPS細胞を樹立し、RPE細胞に分化させました(4)。眼は他の臓器に比べて免疫抑制性が強く、MHC主要6座のうち一部だけを除去したサルiPS細胞由来のRPE細胞を移植した in vivo 試験及び in vitro の検証で、拒絶反応は認められませんでした (3)。逆に、HLAの一部が残ることによって、腫瘍に対する自然免疫の発動が保持され、ウイルスに対する抵抗性が確保されます。少なくとも眼内移植においては、拒絶応答抑制と安全性の両面から有効と考えられます。
Reference
- 1. Mandai M, Watanabe A et al. N Engl J Med 2017
- 2. Takagi S, Mandai M et al. Opthalmol Retina 2019
- 3. Sugita S, Mandai M et al. J Clin Med 2020
- 4. Ishida et al., in preparation
視細胞の再生
現在、日本をはじめとする高齢化の進む国における主な失明原因となる視細胞障害は、視細胞の発生・構造・機能に重要な遺伝子の変異か、視細胞の機能維持に重要な役割を持つRPEの変性に起因することが分かっています。しかしながら視細胞変性を根本的に解決するような治療法はいまだ確立していません。
そこで、私たちは失われた視細胞を幹細胞から作製し、患者に移植する再生医療の開発を進めています。視細胞の多くが失われた段階においては、ES細胞やiPS細胞から分化誘導した網膜オルガノイドの移植による視細胞再生が有効な治療法として期待されています。患者本人のiPS細胞は病気の原因となる遺伝子変異をもつため、基本的には他家の、遺伝子異常を持たないiPS細胞から移植用網膜を作製することになります。他家移植には免疫拒絶反応がリスクとしてつきまといますが、神経網膜は拒絶反応が起こりにくい組織として知られています。
私たちの共同研究機関である神戸市立神戸アイセンター病院では、網膜オルガノイドを用いた、網膜色素変性向けの再生医療の臨床研究を開始しており、治療の安全性を示す結果を得てきています。私たちはこの治療をより多くの患者さんへ届ける為、更なる安全性・有効性の向上を目指して開発を続けていきます。
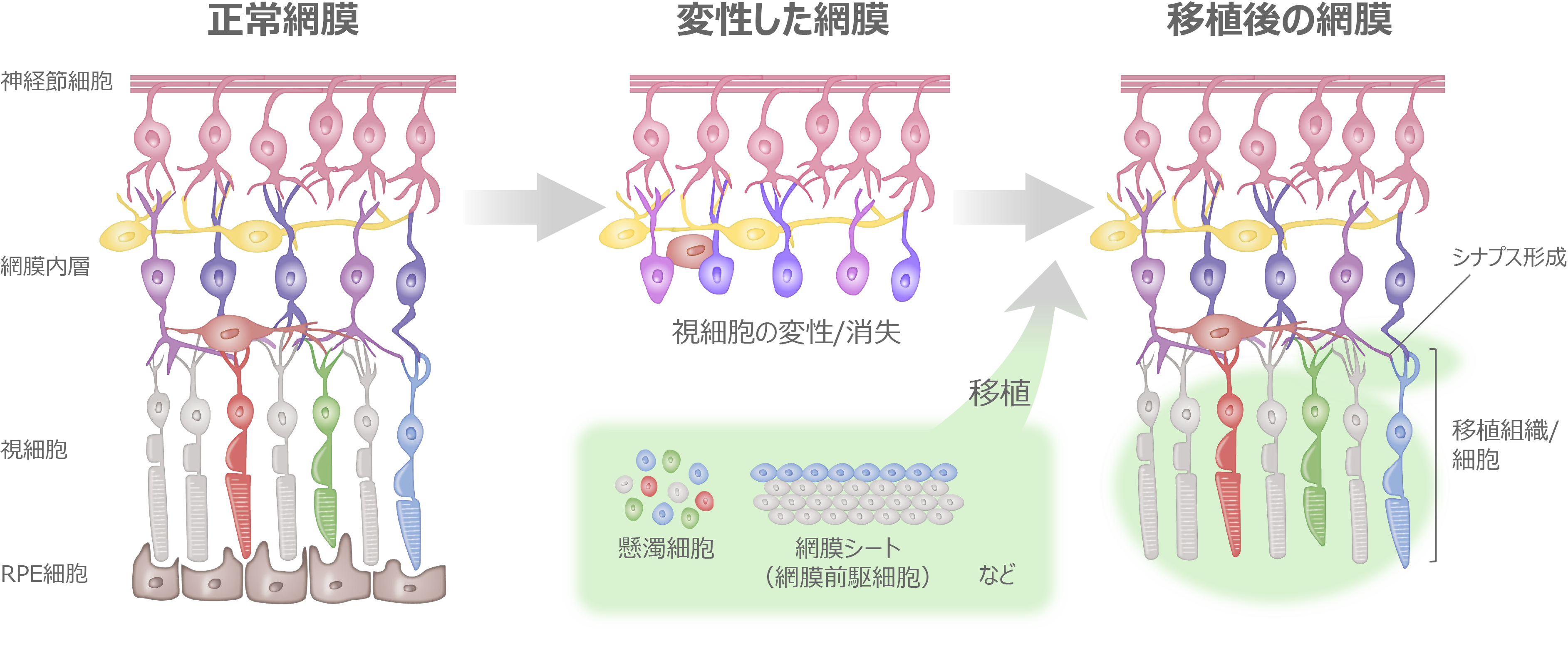
網膜オルガノイドの開発と臨床応用
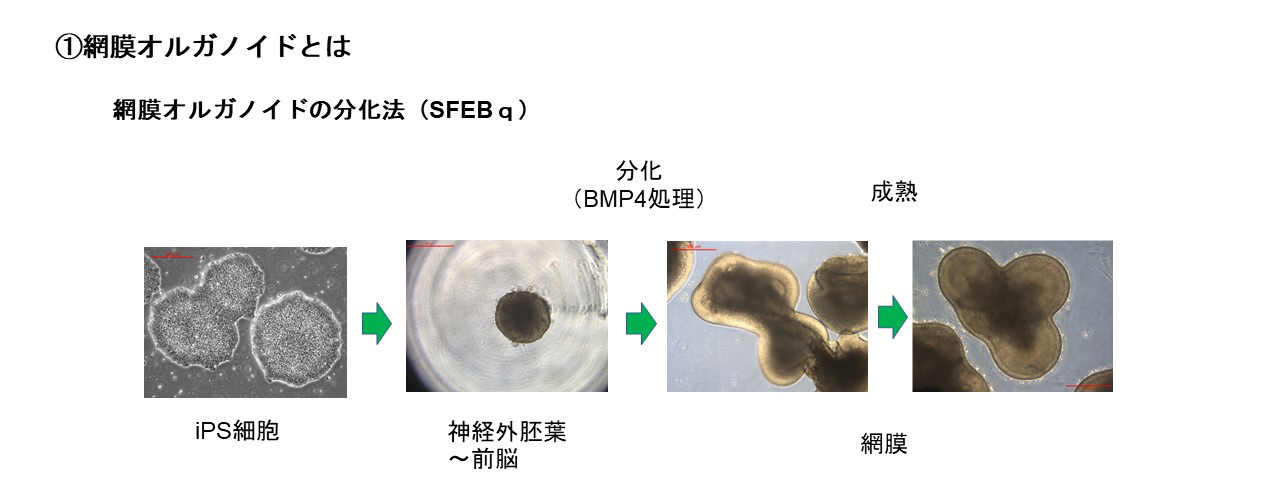
網膜オルガノイドとは生体内の網膜”様”の構造を持つ立体組織で、ES細胞(胚性幹細胞)やiPS細胞(多能性幹細胞)から
in vitroで液性因子を用いて分化誘導することで作り出すことができます。発生過程はin vivoの網膜発生と同様に進行します。また組織形成は細胞間の相互作用のもと自律的に進行し、外顆粒層、内顆粒層、神経節細胞層の3層構造が形成されます。この過程において、視細胞を含む全ての細胞種も網膜前駆細胞から分化します。
接着培養や浮遊培養などの培養方法や、誘導方法に用いる液性因子に多少の違いがありますが、ES/iPS細胞から神経外胚葉を経由し網膜に誘導する分化方法が一般的です。私たちの開発ではTGFβファミリーに属するBMP4による網膜分化誘導方法を用いています。Serum-free Floating culture of Embryoid Body-like aggregates with quick reaggregation(SFEBq)法がその代表的手法で、ES/iPS細胞の凝集塊を浮遊培養し、BMP4を用いて網膜への分化誘導刺激を加えます。揺り戻し法を組み合わせることで非常に高品質な網膜オルガノイドを作製することが可能になります。実際、神戸アイセンター病院で2020年に行われた、網膜色素変性患者への世界初のiPS細胞由来網膜シート移植にはこの手法を用いて作製された網膜オルガノイドが用いられました。私たちはこの誘導方法をベースに開発された、より大型の網膜オルガノイドの作製技術を用いて移植用網膜を作製しています。
網膜変性疾患の患者由来iPS細胞から網膜オルガノイドを分化した場合は、その病態の解析に用いたり、疾患の進行を抑制するのに有効な治療薬の開発などに用いることができます。私たちは網膜オルガノイドを移植組織として用いることで、失った視野や視力の回復を目指しています。
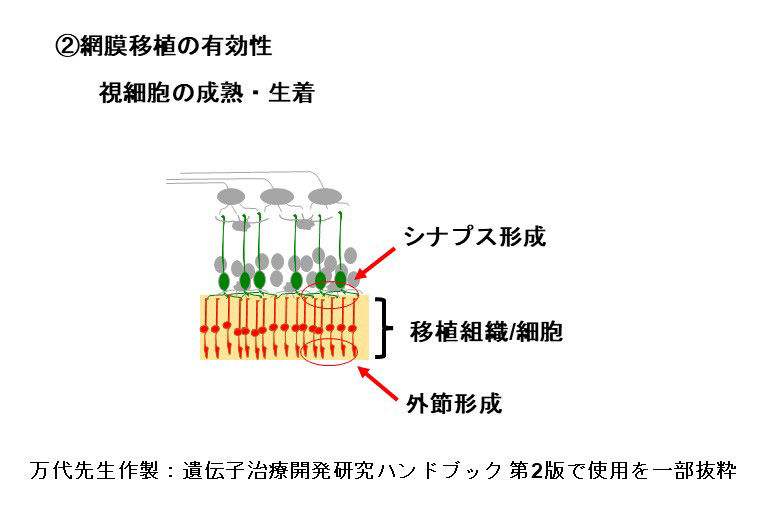
再生網膜の有効性
移植に用いる網膜オルガノイドは、主に網膜前駆細胞と視細胞前駆細胞から構成されており、これらの細胞は移植後に成熟します。その結果、視細胞に外節構造が発達するとともにオプシンやトランスデューシンなどの機能分子も発現し、光報情伝達経路が発達します。また光情報を双極細胞を含む二次ニューロンに伝達するためのシナプスも形成されます。
私たちがヒト網膜オルガノイドから調整した網膜シートをモデル動物に移植したところ、移植視細胞は十分に成熟し、生体内の視細胞と同等の外節構造が発達することを電子顕微鏡を用いた観察で明らかにしました。また光情報伝達に必要な機能分子が発現していることと、移植視細胞がホスト側双極細胞とシナプス結合していることを示唆する結果も免疫組織化学的手法により示されています。またサルを用いた移植試験から、移植後2年以上経過しても移植視細胞の生着状態が良好であることを確認しています。
移植視細胞がホスト網膜と機能的に繋がっていることを示すために、多電極電極アレイシステム(Multi-electrode-array, MEA)を用いた電気生理学的な検証も行っています。具体的には視細胞が変性した末期の免疫不全網膜変性ラットにヒト網膜オルガノイドから調整した網膜シートを移植し生着させた後、ホスト網膜を移植網膜とともに取り出し、ホスト側神経節細胞の光に対する応答をMEAで記録しました。その結果、移植網膜が存在する部位でMEAの応答が検出されました。このことは移植視細胞が光に対して応答すること、さらにその信号がホスト網膜に伝達されていることを示唆しています。
マウスiPS細胞由来網膜オルガノイドを末期視細胞変性モデルマウスに移植後行った行動実験(shuttle aviodance test)では、網膜移植を行ったマウスが光に反応できたことから、光に対する移植視細胞の生理学的応答が行動に反映されることが示唆されました。また、人工的に視細胞変性を起こしたサルの網膜下にヒト網膜オルガノイドから調整した網膜シートを移植したケースでは、visually-guided saccades(VGS)テストにより視野の改善を示唆する結果が得られました。
次世代の網膜移植
私たちはiPS細胞から分化誘導した網膜オルガノイドから切り出した組織片(網膜シート)を移植する方法を採用しています。網膜シートは移植時には主に網膜前駆細胞と視細胞前駆細胞から構成されており、移植後に成熟し、視細胞が形成されます。またその過程で双極細胞や水平細胞などの二次ニューロンや、ミューラーグリア細胞なども分化します。このような未分化な組織の極性を維持して移植する網膜シート移植では、視細胞を精製し懸濁液で移植する方法に比べ、長期に渡って安定的に移植視細胞が生着することが分かっています。
一方で、移植網膜内で分化した視細胞と二次ニューロンがシナプス結合し、移植視細胞とホスト側の二次ニューロンとのシナプス結合を阻害するリスクが存在します。そこで現行の移植網膜を改良し、移植による治療効果を最大化するための検証を行っています。その1つとして、遺伝子編集技術を用いて網膜に存在する遺伝子の発現を制御した次世代型の移植網膜を作製しています。移植網膜の分化・成熟過程を改変することで、ホスト網膜とのシナプス結合効率の改善を目指します。
細胞製造技術
再生医療に用いる細胞培養、特にiPS細胞を用いて網膜細胞を製造する場合などは、手順は決まっていますが、培養する人の技術によって出来具合が変わります。特にiPS細胞の培養では培養液の注入スピードなど微妙な手技も影響することが知られています。
一つ一つの臨床試験は膨大な基礎研究の上に成り立っています。その基礎研究の多くは、このように優れた技を有する熟練研究者の暗黙知やノウハウによって支えられていますが、バイオロジーでは手技に依存して再現性が得にくいなどの問題があります。そこで、将来は実験を規格化できるロボットに移し、バイオロジーを進化させようというロボティックバイオロジー(1)の研究が進んでいます。我々はその理念に賛同し、再生医療への応用を目指して、理化学研究所との共同で培養技術を順次ロボットに移しています。
ロボットとAIへの技術の継承
これまでに私たちのチームは、汎用ヒト型ロボットLabDroid「まほろ」を開発するロボティック・バイオロジー・インスティテュート株式会社および、AIをはじめとした情報技術を開発するエピストラ株式会社とともにロボットとAIを駆使した次世代型の生物学実験の確立に取り組みました。まほろは2本の腕を使って人と同じ装置や道具を用いて実験を行うヒューマノイドロボットです。
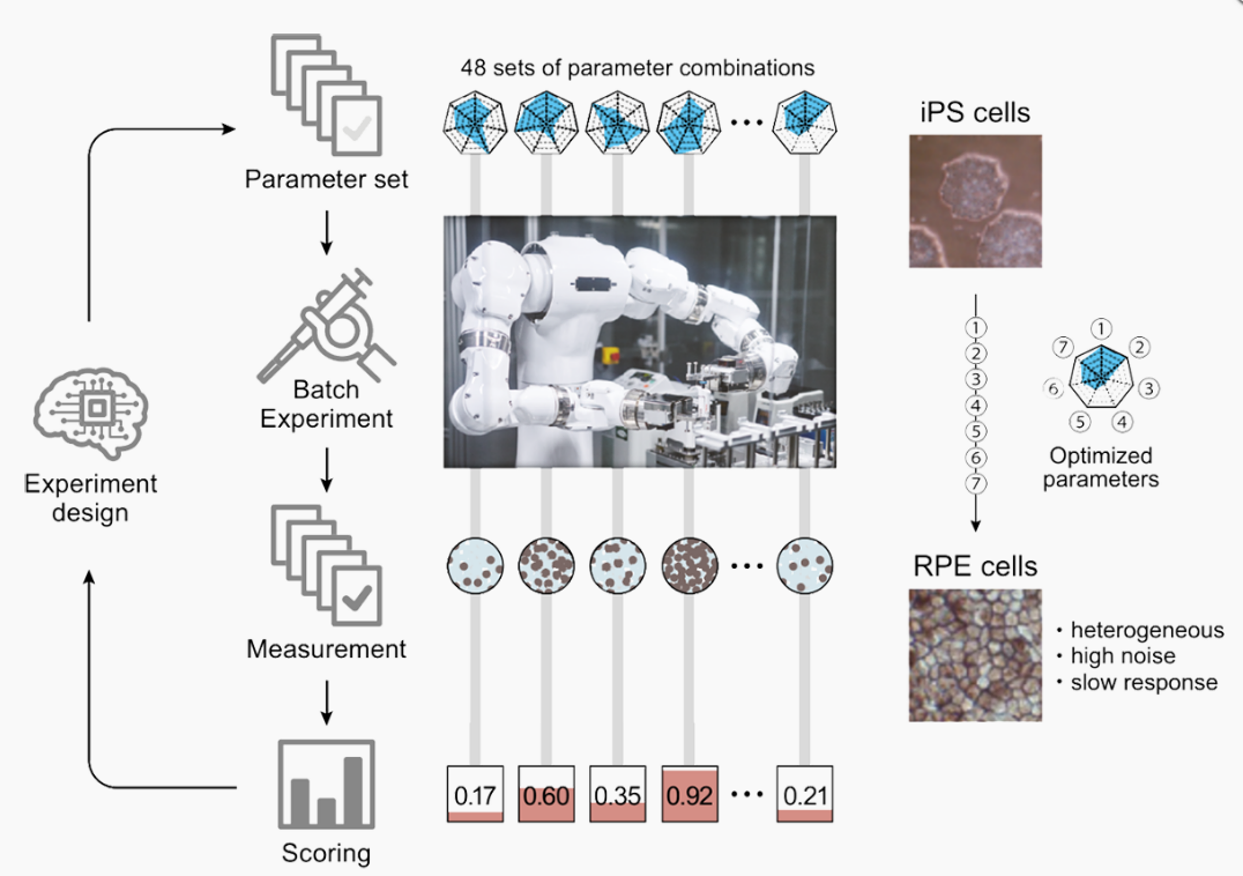
分化誘導プロトコール作成は、細胞培養において最も経験やスキルに依存する実験プロセスの一つであり、分化誘導法の最適条件の確立には多くの場合数年を要します。私たちは、人工多能性幹細胞由来網膜色素上皮(iPSC-RPE)細胞の分化誘導法探索を自律的に行う、バッチベイズ最適化アルゴリズムを用いたロボットAIシステムを理化学研究所とともに開発しています。理研から報告した論文(2,3)では、2億通りのパラメーターの組み合わせから、143通りの条件での細胞培養を111日間で行い、その結果、色素出現スコア(RPE細胞割合)が、事前に最適化された培養で得られたものより88%優れたiPSC-RPE産生を実現しました。また、AIで培養細胞の増殖速度を予測し、80%コンフルエントになる時刻に「まほろ」が細胞の継代を完全自動で行うシステムも開発しました(3)。自律型ロボットAIシステムの使用により、実験探索空間の系統的かつ偏りのない探索が劇的に加速されることを実証しており、医療や研究での活用が大いに期待されます。
Reference: Kanda et al., 2022, elife
ロボット・AIによる細胞製造
当社はこれまでの基礎研究分野における技術開発をさらに発展させ、細胞製造のロボット・AI化に取り組んでいます。臨床に用いる細胞を対象として、高品質な細胞を安定して製造するプロセスの開発に挑戦しています。すでに神戸アイセンター病院の細胞培養加工施設において、iPS-RPE製造の一部を「まほろ」が担う臨床試験について再生医療等特定認定委員会及び厚生科学審議会(再生医療等評価部会)の承認を得ており、ロボットを臨床用の細胞製造に投入することで安定した細胞製造ができるようにしています。人の培養とプロトコールを変えることなく細胞培養技術の最適化を図ることができたためにスムーズに臨床用細胞製造に応用できました。
また、当社の細胞培養加工施設 Facility for iPS derived retinal stem cell therapy(略称: FiRst 約357 m² )は、2022年10月20日付にて厚生労働省近畿厚生局より、再生医療等の安全性の確保等に関する法律(再生医療等安全性確保法)第35条第1項に基づく「特定細胞加工物製造許可証」(施設番号: FA5220002)を取得しています。FiRstでは、独立して空調管理を行える細胞調製室を2部屋備え、1つの部屋で製造を継続しながら他方の部屋で機器設備の改良/更新が可能。自動化装置の導入および製造法の改良がスムーズに行えるように設計されており、今後の臨床試験用の細胞製造を行います。
Reference
- 1. Robotic crowd biology with Maholo LabDroids. Yachie N; Robotic Biology Consortium; Natsume T. Nat Biotechnol. 2017 Apr 11;35(4):310-312. doi: 10.1038/nbt.3758.1
- 2. Robotic search for optimal cell culture in regenerative medicine. Kanda GN, Tsuzuki T, Terada M, Sakai N, Motozawa N, Masuda T, Nishida M, Watanabe CT, Higashi T, Horiguchi SA, Kudo T, Kamei M, Sunagawa GA, Matsukuma K, Sakurada T, Ozawa Y, Takahashi M, Takahashi K, Natsume T. Elife. 2022 Jun 28;11:e77007. doi: 10.7554/eLife.77007.
- 3. A Variable Scheduling Maintenance Culture Platform for Mammalian Cells. Ochiai K, Motozawa N, Terada M, Horinouchi T, Masuda T, Kudo T, Kamei M, Tsujikawa A, Matsukuma K, Natsume T, Kanda GN, Takahashi M, Takahashi K. SLAS Technol. 2021 Apr;26(2):209-217. doi: 10.1177/2472630320972109.